|
對于做分子實驗的人來說,探針引物,一個很熟悉的詞語,科研人員也會經常用到,但是對于探針引物的設計,您知道多少?今天,我們就簡單的談下這種引物的設計。
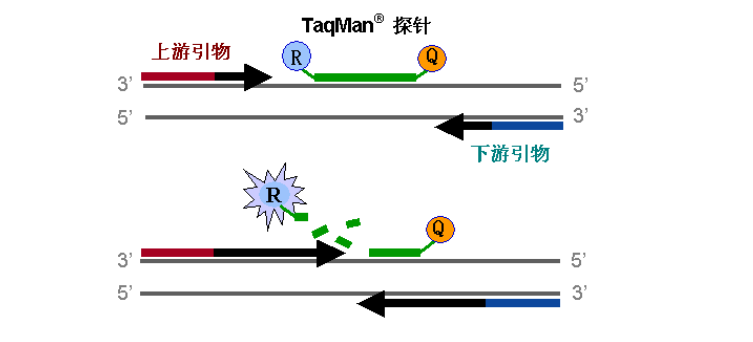
通用原則
-
先選擇好探針,然后設計引物使其盡可能的靠近于探針;
-
擴增子的長度應不超過400bp,理想的最好能在100-150bp內,擴增片斷越短,有效的擴增反應就越容易獲得,較短的擴增片斷也容易保證分析的一致性;
-
保持GC含量在20%和80%之間,GC富含區容易產生非特異反應,從而會導致擴增效率的降低,及在SG分析中非特異信號;
-
為了保證效率和重復性,應避免重復的核苷酸序列,尤其是G(不能有4個連續的G);
-
將引物和探針互相進行配對檢測,以避免二聚體和發卡結構的形成。
探針設計指導
-
在設計引物之前設計探針;
-
探針的Tm值應在68-70℃之間,如果是目測探針,則要仔細審查GC富含區;
-
探針的5'端要避免有鳥氨酸,5'G會有淬滅作用,即使被切割下來這種淬滅作用也還會存在;
-
選擇C多于G的鏈作探針,G的含量多于C會降低反應效率,這時就應選擇配對的另一條鏈作為探針;
-
探針應盡可能的短,不要超過30個bp;
-
檢測探針的DNA折疊和二級結構。
引物設計指導
-
引物的Tm值應在58-60℃之間,這非常重要,因為我們的試驗一般都使用退火溫度為60℃,在這個溫度下,5'核酸外切酶的活性****;
-
引物末端(最后5個核苷酸)不能有超過2個的G和C;
-
將引物盡量接近于探針。循環參數當引物和探針按照上述原則設計好后,循環的參數也就確定了,當經過起始的變性溫度后(根據Tag酶要求設定),反應要經過95℃,15-20秒,60℃,60秒,對于一些模板,45秒也足夠了,數據在退火時檢測。
優化探針和引物的濃度
對于雙探針反應,通過選擇探針和引物的濃度來優化反應結果,能獲得最低的CT值,以及相對于背景來說熒光值有****的增長。引物濃度應該在50nM-900nM 范圍內進行優化,探針濃度應該在50-250nM范圍內優。
探針的濃度應該從(50,100,250nM)與引物濃度相組合,在Rotor-Gene上進行試驗,選擇最小CT值和****反應擴增的曲線做后續試驗。
通常所用的探針和引物濃度分別為250nM 和900nM,絕大多數反應都可以在這個濃度下進行,但為了尋找****的濃度,還是應該依照上述的步驟。由于引物溶解溫度預測的差異和多種探針設計程序,因此使用三種退火溫度(58℃,60℃,62℃)對優化是很有用的。
引物的濃度也會影響溶解溫度,高的引物濃度會讓溶解溫度提高2度左右。Primer3是個非常有用的軟件,但它不能避免3'端的G,所以應將3'端的G去除,并觀察探針的退火溫度是否比引物高8-10度。

定量數據的分析
分析定量數據主要有兩種基本的方法:絕對定量和相對定量。研究人員應該根據擴增子和試驗目的來決定如何分析定量數據。
(1)絕對定量
絕對定量是將未知樣品與標準曲線相比較進行分析,一般標準品就是一個已知絕對濃度的DNA樣品,關于何種標準品用于標準曲線一直有很多討論,理想的標準品其擴增方式應該是與待測樣品一致得,然而這往往是不可能的。一些人會克隆他們得目的基因,并與未知樣品比較。要注意得是,絕對定量分析的準確性是依靠標準品的準確性得。
在Rotro-Gene 上可以用幾種方法來分析絕對定量數據。包括標準曲線在內的R值,反應效率都會被呈現出來。也可以從以外的分析中調用標準曲線并讓它與一個標準品相調整,(或重復相同的標準品),這個功能在確定斜率的重復性好與Y截距的基礎上完成。對一個標準曲線來說,一個單獨的標準品就已經足夠了,也可以在不同的通道甚至一個通道內繪制多條標準曲線。
(2)相對定量
相對定量是指兩個或更多的基因互相進行比較,其結果是一個比率,沒有確切的數字被檢測道。一種檢測基因表達相對定量的方法叫"比較CT值法(⊿⊿Ct)",這種方法可以徹底不需要標準曲線,通過觀察與一個動態相關對sPCR照比較的表達水平,從而可以將模板與增加的樣品間進行相對定量。要使這種方法成功,目的及參照的動態范圍應該相類似。
相對的一個敏感的方法就是看⊿Ct(相同的起始模板濃度,兩個擴增子的兩個CT值的差異)隨著不同稀釋度的模板有什么變化。如果兩個擴增子的反應效率大致相同,則the plot of log input amount versus ⊿Ct 將是一條水平線(斜率<0.01)。這意味著在初始模板濃度范圍內,兩個擴增子有相同的反應效率。如果檢測發現效率不一致,則應該用標準曲線來對基因表達進行定量,或優化反應獲得一個類似的效率。

|
